对国内抗体药物行业发展的思考
来源:医药行业研究员 张伟2017-09-28
国内目前在抗体药领域布局的企业相当的多,虽然涉足的时间长短不同,但很明显大家都把抗体药作为了未来发展的重要方向。这个趋势从每年全球前十大药物排行榜也都可以看出来了,前十中有6-7个药物都是抗体药(或融合蛋白)。在中国,虽然过去抗体药物销售额还比较小,但未来几年肯定要慢慢和国际接轨了。原因是过去单抗药物价格昂贵,没有医保覆盖,绝大部分患者无法承担。现在不少单抗药品已通过医保谈判的方式进入医保,例如美罗华、赫赛汀等,价格大幅下降,且有医保承担一部分费用,患者的负担大为降低。这些都是临床的刚需用药,可以预见未来的使用量会大幅上升。目前国内医保支付的策略是“腾笼换鸟”,每年的医保支出增幅收到严格控制,一般不超过10%,但是对药品的支付策略却有着根本性的变化:临床效果好、急需药品都有着政策上的倾斜和优先待遇,而过去许多在医保里的大品种,安全而无效的药品,没有原研药效果的仿制药,在以后日子都不会好过,会逐步被医保边缘化。
随着国际上的单抗重磅品种专利陆续到期,针对这些年销售额几十亿、上百亿美金的单抗产品,全球进入了抢仿时代。而国内现在做抗体药的企业还真不少,估计有600多家,又是一个玩家扎堆的热门行业。今天我想分析的就是国内的这些做抗体药物的企业未来会怎样?这个问题应该说很难回答,因为我也没有发现有人给出这个答案。但是还是可以先大致分析一下目前的情况。现在做的比较多的抗体有两类,一是生物类似药,即抗体原研药的仿制药,但要求必须证明其与原研药在结构、效果等方面的一致性。所以研发难度还是非常大的,投入也很大,因为临床需要做与原研药“头对头”的比较,估计光是临床试验就需要2-3亿元人民币的投入。再考虑到商业化生产,需要建立自己的抗体药生产基地,还要克服生产工艺放大的问题,投入就更大了,技术壁垒也非常高。还有一类是针对肿瘤免疫检查点的抗体药,这是一类广谱性的抗肿瘤药,是现在的明星药物,以PD-1、PD-L1靶点为代表的一类单抗药,市场预计未来全球销售额能有一两百亿美金。国内这些抗体药都是以创新药的身份申报的。最后还有些公司是做创新抗体药的,他们于错过了最早进入行业的时机,研发进度较慢,因此通过做其他靶点的创新单抗,与以上两类企业错位竞争。
先说生物类似药,下面这张图是中泰医药的统计,对国内企业在生物类似药这块做了一个很好的总结:
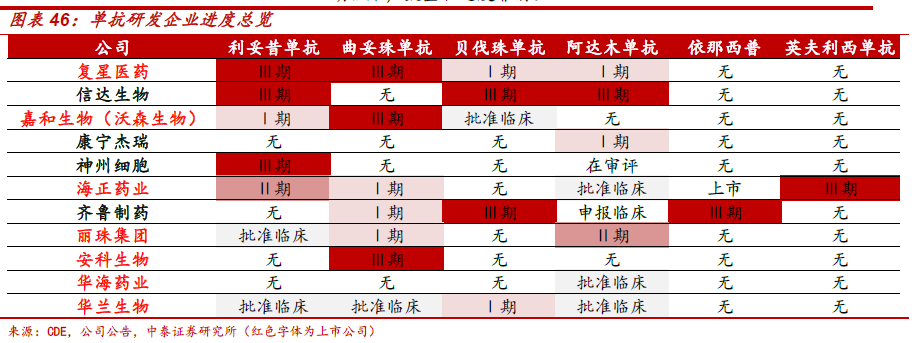
可以看出,第一梯队的企业是复星医药和信达生物。复星医药的利妥昔单抗和曲妥珠单抗都在临床3期,分别有望在明后年上市,利妥昔单抗有望成为国内第一个上市的生物类似药。信达生物有3个生物类似药在临床三期,有望在2019-2020上市。这两家企业的单抗都是按照生物类似药的标准做的,即临床都要做头对头的试验。而有些企业是按照新药申报的,并没有与原研做头对头的比较,因此,未来有可能还得重新补试验。当然,国内的市场不只是国内公司的,也是跨国药企的必争之地。这几天有消息显示,美国安进公司联手先声计划开发中国生物类似药市场。
汤森路透数据显示,目前我国临床前在研生物类似药数量超过美国居首,核心专利数量也位列全球第三,仅次于美国和欧盟,关注领域以肿瘤、糖尿病和免疫系统为主。生物类似药申报企业和申报品种数量众多,大部分药品均有数家公司“仿制”,同一品种竞争非常激烈。因此,除了这张表的企业,还有大量的企业在陆续申报临床。
第二个领域,针对PD-1、PD-L1靶点的单抗数量也是非常之多。截至2017年7月10日,共有15个国产PD-1/PD-L1类药物申报临床,包括10个PD-1单抗和4个PD-L1单抗,1个PD-L1单域抗体。
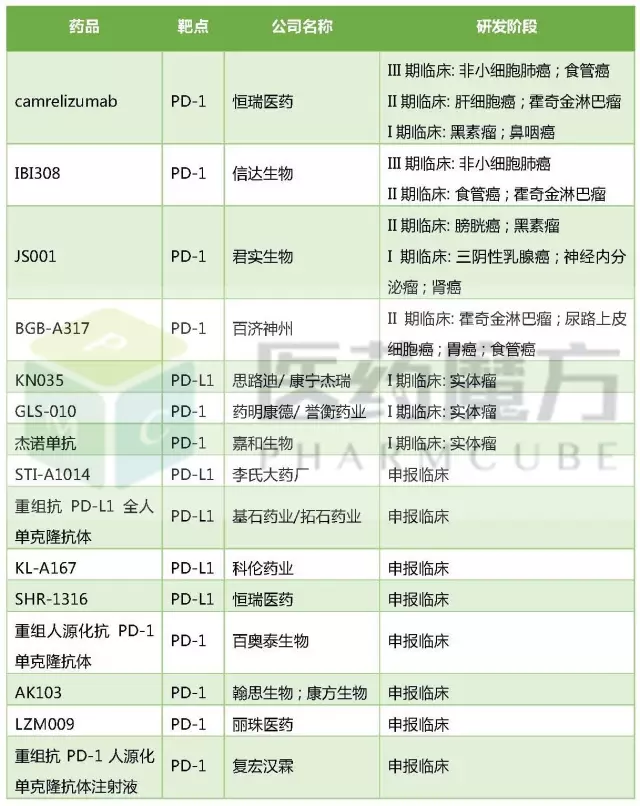
来源:医药魔方发现
所以回到最初的问题,这么多的企业做单抗药物研发,还有很多做创新生物药、双特异性抗体的公司,行业很火热,也很拥挤,最后行业是个什么样的格局,谁会胜出呢?这个问题我自己思考了很久,也问了一些产业里的专家,参加了券商的策略会去学习,有了一些初步的看法。先说生物类似药,它是原研药的仿制药,现在不少原研药已经进医保了,但是降幅很大,曲妥珠单抗从2万多一支降到7千多一支,如果仿制药上市,价格还得要低一些,所以未来考验生物类似药的很重要的一个因素就是成本。如果不能把成本降低以保证自己的利润率,估计就是赔本赚吆喝了。第二点,我认为企业自身的研发和技术实力很重要,现在CFDA发临床批件速度很快,不过最终企业的产品能否顺利上市还是要看产品质量是否过硬,能不能实现商业化生产。所以虽然玩家很多,但是最终产品能上市的估计不会多。最后一点,先发优势还是很重要的,率先上市的企业获得的关注度最高,对产品推广也最有利,抓住领跑的这段时间优势,很有可能占据固定的市场份额,形成部分垄断的地位。而对于PD-1、PD-L1抗体以及创新生物药,除了以上的因素,产品的疗效更加重要。现在,临床前筛选出一个单抗分子并不困难,关键是它的治疗效果如何。最终,还是产品质量说话。所以,持续关注这些药物的临床试验结果、临床进度,以及获批适应症的数量是非常必要的。
